摩爾是數字的量度。 “摩爾”概念可幫助我們僅使用宏觀的天平即可稱量或計算一定數量的原子(不包括微小誤差)。如果我知道它是葡萄糖,則取180克葡萄糖(因為C6 H12 O6的分子量為180);樣品中含有1摩爾或阿伏伽德羅數(N.A)或6.023 * 10 ^ 23分子的葡萄糖。同樣,18克的H2O必須包含1摩爾或6.023 *(10 ^ 23)的水分子。
但是如何?
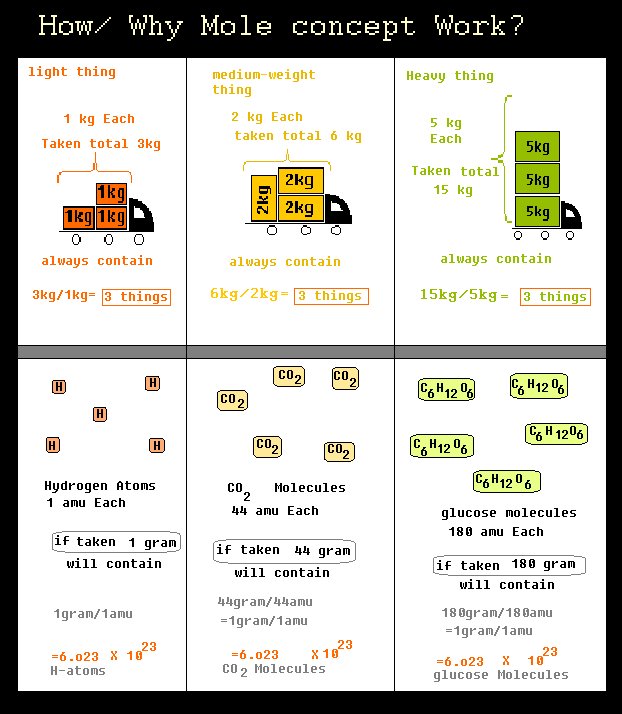
讓我們從一些宏觀物體開始。
如果我們乘一輛裝滿磚頭的卡車和另一輛裝滿磚頭的卡車;第二輛卡車所載的磚屑要比第一輛卡車多得多。很簡單。
但是,如果我們拿了1塊卡車磚(磚的總重量很重),那麼,和一桶碎木片(碎木片的總質量比卡車狀磚輕得多)...然後呢?也許兩者都將包含相同(至少幾乎)數量的粒子。
即如果我們要處理大量的重物,而要處理較輕的輕物;
用定量的術語表示:
說每個積木= 1克1磚= 1000克。
現在,如果我們取1234 * 1克磚塊和1234 * 1000克磚塊;
或者如果我們在一個地方取X * 1克磚塊,而在另一個地方取X * 1000克磚,則單位粒子數目相同。在兩種情況下,我們得到的數字都是相同的。
分子尺度
1個氫原子(H)重1 am。 1分子葡萄糖(C6 H12 O6)的重量為180 a.m.u. 1分子H20的重量為180 a.m.u。
現在,1克= 6.023 *(10 ^ 23)道爾頓或N.A. a.m.u. (*)
所以就像我們上面提到的積木示例一樣
1克氫(H)原子(或NA amu H)或180克葡萄糖(即NA * 180 amu葡萄糖)或18克水(NA * 18 amu水)將包含相同數量的顆粒(由於gram和amu之間的關係,此處為6.023 *(10 ^ 23)個或NA個)。這樣,在此示例中1摩爾任何物質都將包含NA個分子
Avogadro數(N.A.),其作用方式與前面的磚示例中的X相同。
這是比較實際示例和化學示例的簡化圖。
優點
我們給出了
1 C6 H12 O6 + 6 O2 = 6 CO2 + 6 H2O
化合物式左側的數字,或化學計量係數;是完成反應所需的最小數量的分子。
我們給了一定量的葡萄糖,並詢問在O2中完全燃燒後釋放出的CO2量是多少?
我們可以從a.m.u重新計算出來。較大的計算。
但是摩爾概念大有幫助,因為我們可以從分子式和化學計量係數直接以克為單位確定反應物和產物的量,而無需使用克和amu之間的任何單位轉換
如果我們可以將整個反應相乘
(相應化合物的180 amu + 6 * 32 amu = 6 * 44 amu + 6 * 18 amu)
帶有NA(一次可以運行NA個此類反應的次數)
i。 e。
180 amu * NA + 6 * 32 amu * NA = 6 * 44 amu * NA + 6 * 18 amu * NA(分別為化合物)
或
1摩爾葡萄糖+ 6摩爾O2 = 6摩爾CO2 + 6摩爾H2O。
或
180 克 + 6 * 32 克 = 6 * 44 克 + 6 * 18 克(分別為化合物)。
一旦我們知道了事實,我們可以使用摩爾分子。我們可以輕鬆地將反應寫成摩爾平行反應。然後,使用化學式將摩爾數轉換為克數,即可輕鬆確定某些反應物或產物的需求量或獲得量。對於給定值為1的反應物或產物
,例如2 H2 + O2 = 2 H2O。從這個反應中,我們很容易得出結論:2摩爾的H和1摩爾的O 2形成2摩爾的H 2O。或2 * 2 g H2和32 g O2產生2 * 18 g H20。現在使用統一方法,我們可以從一定數量的反應物或產物中找到一定數量的反應物或產物。
引用:
-
(* ): http://chemistry.bd.psu.edu/jircitano/mole.html
-
Google單位轉換結果 維基百科中的a>
-
阿伏加德羅常數
-
維基百科中的原子質量單位
-
維基百科中的摩爾(單位)
-
中的原子質量維基百科
-
維基百科
-
維基百科
-
我們在基礎化學課上所學的內容
ol>